アンジェス株式会社は、希少遺伝性疾患検査を主目的とした衛生検査所「アンジェスクリニカルリサーチラボラトリー」(以下、「ACRL」という)において、希少遺伝性疾患の検査業務拡大に向けた「遺伝学的検査」の技術を確立し、2023年冬に「遺伝学的検査」受託を開始いたします。
【遺伝学的検査について】
ACRLでは、2021年4月1日より一般社団法人 希少疾患の医療と研究を推進する会(以下、「CReARID」という)から「拡大新生児スクリーニング検査(※1)」であるオプショナルスクリーニングを受託しております。拡大新生児スクリーニング検査は、対象となる希少遺伝性疾患の可能性の有無を判断するためのデータを提供することを目的とした検査です。ACRLでは、2022年に年間約1万件の検査を実施しております。
今回新たに技術を確立した「遺伝学的検査」は、スクリーニング検査の結果で疾患の疑いがある場合、また、発症した症状から該当の疾患である可能性がある場合に、該当の疾患かどうかを確定させる検査(確定検査)となります。
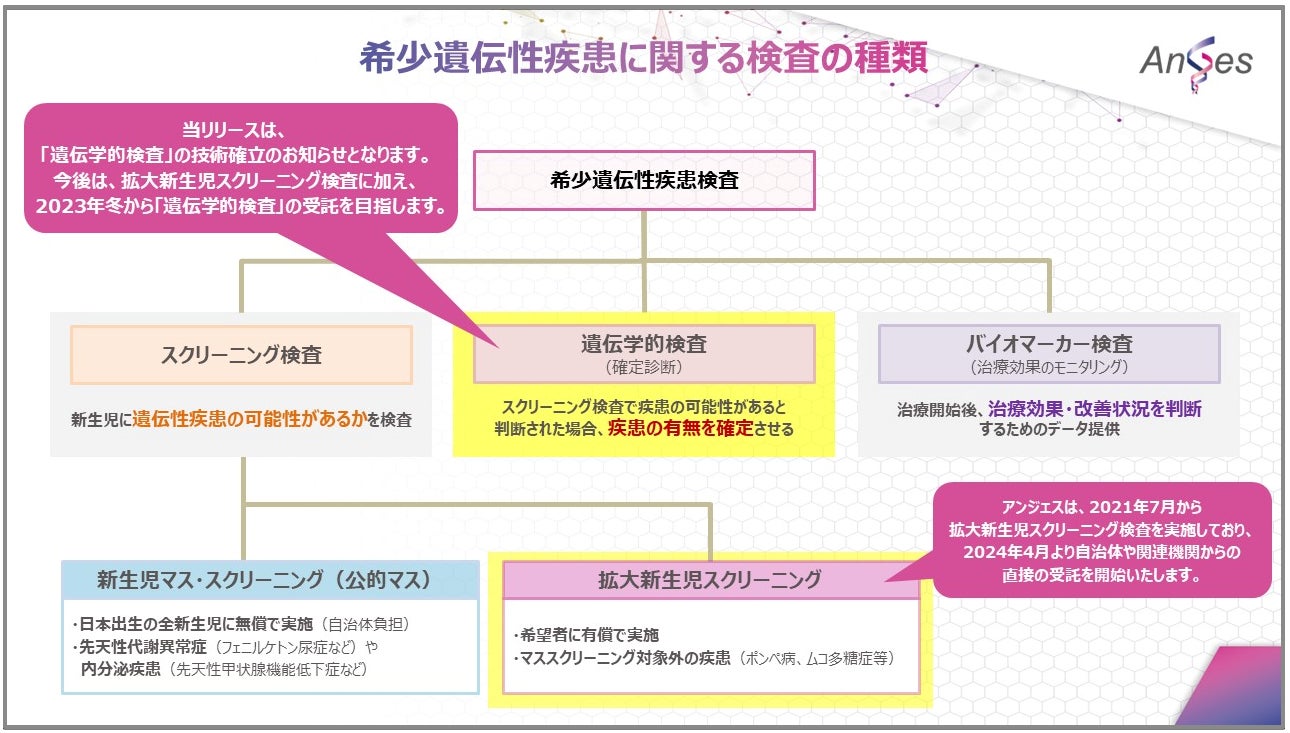
2021年から2年間のオプショナルスクリーニング受託をとおして、国内ではスクリーニング検査と遺伝学的検査を異なる衛生検査所に依頼しなくてはならないという現状が、希少疾患診療に携わる医療関係者の大きな負担となっていることをお聞きしました。そして、スクリーニング検査から遺伝学的検査を一括して委託できるようになってほしいという切実なご要望を多数頂戴いたしました。このようなご要望に応えるべく遺伝学的検査(確定検査)の技術を確立し、受託できる体制を整えることで、ACRLでは、希少疾患の可能性を探る「スクリーニング検査」から、どのような疾患なのかを判断する「遺伝学的検査(確定検査)」までをワンストップで提供できることになります。このような体制を構築することは、希少遺伝性疾患の早期発見・早期治療のプロセス効率を最大化できる点でも有効であると考えております。
また、当社が米国Eiger社から導入し、現在承認申請中のゾキンヴィ(一般名:ロナファルニブ)の対象疾患であるハッチンソン・ギルフォード・プロジェリア症候群(HGPS)(※2)及びプロセシング不全性のプロジェロイド・ラミノパチー(PL)を対象とした遺伝学的検査(確定検査)の技術も確立しました。早ければ2024年春からの検査開始を目指し、遺伝学的検査の受託に向けた準備を進めております。なお、ゾキンヴィは2023年3月に希少疾病医薬品(オーファン・ドラッグ)に指定されております。
※1 拡大新生児スクリーニング検査の対象疾患は、ムコ多糖症I型、II型、IVA型、VI型、ファブリー病(男児のみ)、ポンペ病、副腎白質ジストロフィー(男児のみ)、脊髄性筋萎縮症、重症複合免疫不全症の9疾患となります。
※2 HGPSは、LMNA遺伝子の点突然変異により、ファルネシル化された異常タンパク質であるプロジェリンが生成されることにより発症し、HGPSの子どもたちは平均14.5歳までに、成人がかかるのと同じ心臓病(動脈硬化症)で死亡するのが一般的です。病気の症状には、深刻な成長障害、強皮症に似た皮膚、全身性脂肪性筋萎縮症、脱毛症、関節拘縮、骨格形成不全、心血管系の衰えを伴う全身性動脈硬化の促進、衰弱性の脳卒中が含まれます。
【アンジェスについて】
・商号 :アンジェス株式会社
・本社所在地:大阪府茨木市彩都あさぎ七丁目7番15号 彩都バイオインキュベータ
・代表者 :山田 英(代表取締役 社長)
・事業内容 :遺伝子医薬品の研究開発
・資本金 :34,559百万円(2023年5月10日現在)
・設立日 :1999年12月17日
・証券コード:4563(東京証券取引所グロース)
アンジェスは、遺伝子医薬技術を活用し、革新的な医薬品開発に取り組むバイオ製薬企業です。遺伝子医薬のグローバルリーダーを目指し、遺伝子の働きを利用した新しいタイプのバイオ医薬品である遺伝子医薬の開発を行っています。
当社は、大阪大学の基礎研究を基に1999年12月に設立されて以降、研究と開発の段階を経て、足の血流が極度に悪化する慢性動脈閉塞症を対象としたHGF遺伝子治療用製品については、2019年3月、国内における条件及び期限付製造販売承認を取得し、同年9月に田辺三菱製薬より製造販売を開始しました。これは国内では初の遺伝子治療用製品となります。またプラスミドDNAを使用した製品化は世界初となります。
さらに、2023年5月31日には、再生医療等製品の条件及び期限付承認制度の導入後初めて、条件解除のための本承認申請を行いました。
当社はその他にも、椎間板性腰痛症を対象とした核酸医薬「NF-κBデコイオリゴ」の開発や、大変希少な致死性の遺伝的早老症であるハッチンソン・ギルフォード・プロジェリア症候群及びプロジェロイド・ラミノパチーの治療薬ゾキンヴィの日本での独占販売契約を2022年5月に米国のバイオ医薬品企業Eiger BioPharmaceuticals Inc.と締結し、2023年5月12日、厚生労働省に国内製造販売承認申請を行いました。ゾキンヴィは厚生労働省により希少疾病医薬品(オーファン・ドラッグ)に指定されました。
さらに、当社子会社であるEmendoBio社では、究極の遺伝子治療であるゲノム編集について先進技術を保有しており、今まで治療法のなかった疾患の治療を可能にするゲノム編集製品を患者の方々に届けできるよう研究開発を進めております。


