ゲノム編集ツールの中でもCRISPR-Cas9は、改変効率の高さや製造上の簡便性等の面で優れ、更にその開発者が2020年にノーベル化学賞を受賞したことからもその創薬応用が期待されています。一方、CRISPR-Cas9の創薬領域におけるライセンスフィは数百億円に達する場合もあり、また基本特許の権利を巡って訴訟問題が継続しており複数の権利者へ高額なライセンスフィを支払うリスクがあります。更に、標的配列の認識領域が他ゲノム編集ツールよりも短くオフターゲットリスクが一般的に高いため、治療上の安全性に対する懸念が指摘されています。
このような背景の下、PtBioはCRISPR-Cas9以外のゲノム編集ツールに着目しました。CRISPR-Cas9以外のゲノム編集ツールとしてTALENやZFNが挙げられますが、TALENの創薬領域におけるライセンスフィはCRISPR-Cas9と同様に非常に高いため、既に基本特許が切れていてライセンス問題が整理されているZFNに着目しました。
従来のZFNは、標的配列を認識し結合するZFとDNAを切断するヌクレアーゼ(FokI Nuclease Domain)からなり、このヌクレアーゼがヘテロダイマー化することにより細胞中の二本鎖DNAを切断します。プラチナバイオは、広島大学が開発した新規のヌクレアーゼND1の独占ライセンスを受け、それをZFに組み合わせることで純国産ゲノム編集ツールZF-ND1を開発し、その医療応用を進めています。ZF-ND1は、従来のZFN同様、スペーサー配列の長さの柔軟性やヌクレアーゼがヘテロダイマーとしてペアリングした時のみDNA切断を誘導する高特異性を有しています。それに加えて、ZF-ND1は従来のZFNと異なり、ヘテロダイマー化によりヌクレアーゼ活性が低下しないという特性を持ちます。このような長所をもつことから、ZF-ND1はオフターゲットリスクを低下させた安全性の高いゲノム編集ツールとして医療応用が期待できます。
■純国産ゲノム編集ツール「ZF-ND1」の創薬応用
PtBioは、広島大学らと連携し、従来報告があるZFNの作製法とは異なり、産業応用上の課題を解決し得る機能的なZF-ND1を効率的に作製する方法を既に確立しています。従来のZFNタンパク質の利用においては、米Sangamo Therapeutics社も使用しているヌクレアーゼFokⅠの収量が少なく製造ハードルが高いという課題がありましたが、ND1は可溶性に優れて発現精製時に凝集し難く、従来のFokⅠよりも10倍以上の収量を得られることが実証されています。また、CRISPR-Cas9のオフターゲットリスクに伴う安全性への懸念が指摘される中、ZF-ND1は、従来のZFNよりも標的配列への特異性と切断・変異導入活性が高く、オフターゲットリスクの低減が期待されています。当社の取締役CTOの山本卓(広島大学ゲノム編集イノベーションセンター センター長・教授)らは、広島大学と連携し、ヒトやマウスの標的遺伝子に機能的なZF-ND1を設計・作製し、その活性評価を培養細胞で行いました。ヒト遺伝子を標的とした実験では、切断活性が45%以上得られ、医療応用に資する切断活性が得られた他、マウス遺伝子を標的とした実験では、CRISPR-Cas9に匹敵する切断活性も得られています。更に、マウス受精卵を用いた動物実験でもZF-ND1の有効性が確認されており、将来的な臨床応用が期待されています。
PtBioは、遺伝子治療や細胞治療への応用を見据えて有効性と安全性を更に高めるため、AIを用いたタンパク質の構造解析や導入技術の開発を、広島大学をはじめとする研究機関と連携しながら進めています。また、今後ZF-ND1を改変し、二本鎖DNAの片方のみを切断するニッカーゼとして使用することやDNA/RNAハイブリッド鎖の切断を可能にすることにより、創薬応用の可能性を広げられると考えています。本取組を皮切りに、難治性疾患の有効な治療法の確立と共に、純国産技術の普及による国際競争力の強化にも貢献していきたいと考えています。
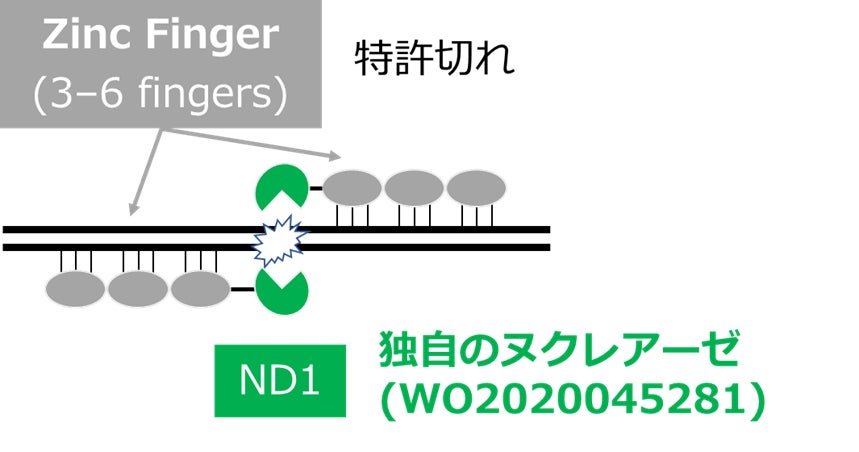 図1 独自のZF-ND1の概要図
図1 独自のZF-ND1の概要図
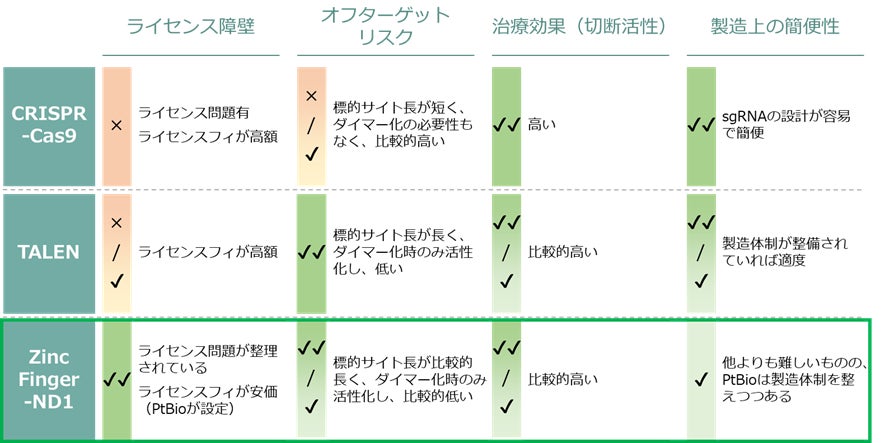 図2 創薬領域におけるゲノム編集ツールの比較
図2 創薬領域におけるゲノム編集ツールの比較
■プラチナバイオ(PtBio)について
PtBioは、広島大学・山本卓教授らの最先端ゲノム編集技術を核にして設立されたスタートアップ企業です。独自のバイオDX技術とゲノム編集技術を梃に、①非モデル生物を含むあらゆる生物のゲノム情報の解読、②目的の生物機能に関わる遺伝子を特定、③ゲノム編集による機能向上の3点を一気通貫で行い、社会課題を解決し得る生物機能をデザインするバイオ・プラットフォーマーとして、様々な事業パートナーとの共創事業を推進しています。
代表者: 代表取締役 CEO 奥原 啓輔
所在地:広島県東広島市鏡⼭三丁⽬10番23号URL:https://www.pt-bio.com/


