本成果は、英国科学誌「Communications Biology」に、2022年11月27日に掲載されました。
- 研究の背景と経緯
アクロメガリーは、血液中の成長ホルモンが正常よりも増加することで、身体にさまざまな兆候を示す病気です。図1のイラストに示すように長い年余をかけて特徴的な顔つきに変化し、四肢末端や舌の肥大を引き起こします。また、心肥大、骨関節症状、代謝異常、悪性腫瘍などの合併症を引き起こし、放置すると正常者よりも平均寿命が短くなると言われています。
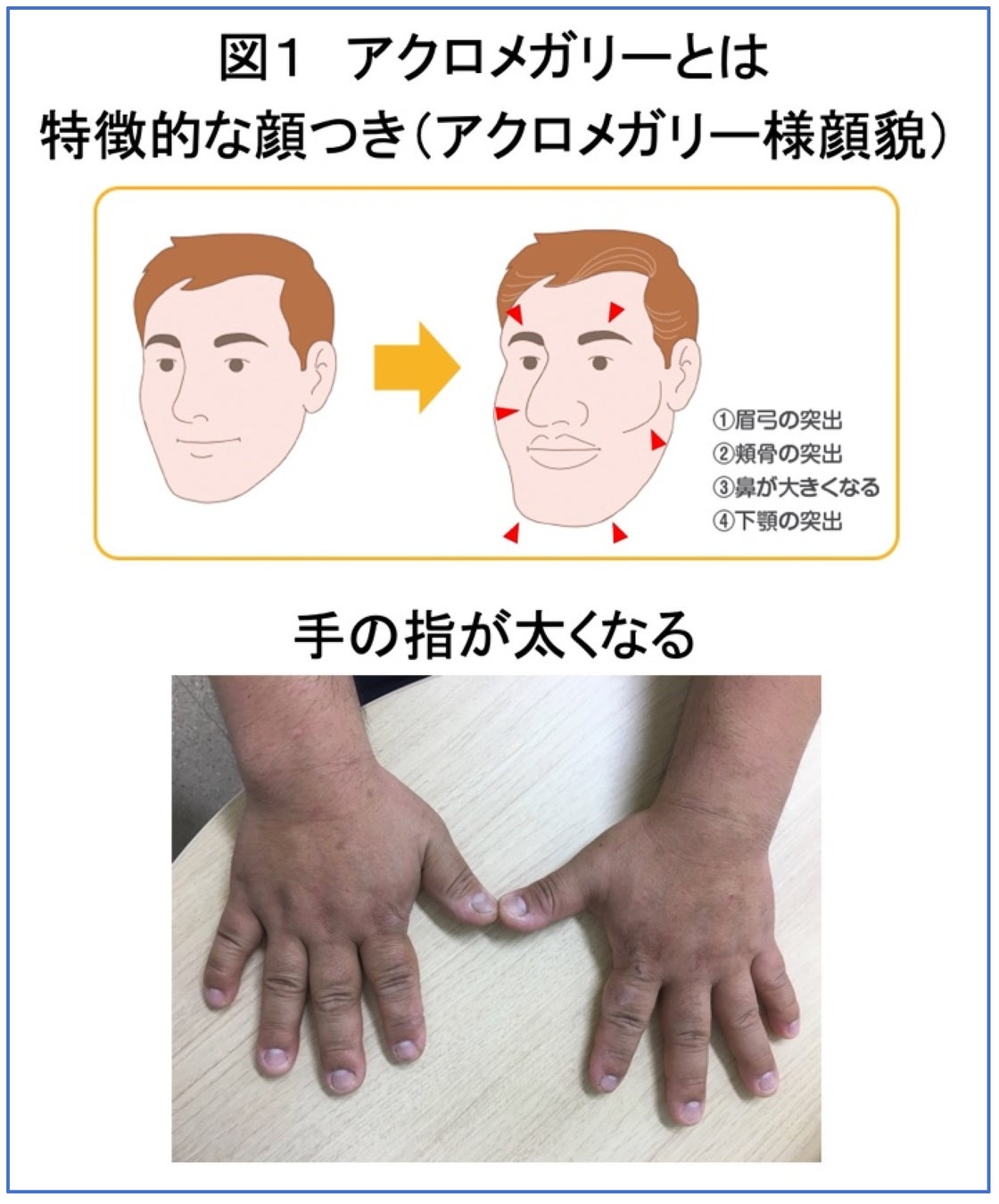
成長ホルモンは脳下垂体という臓器から分泌されますが、アクロメガリーでは、この脳下垂体に図2のような腫瘍ができることで、正常者よりも成長ホルモンが増加してしまいます。アクロメガリーの治療は、手術で脳下垂体に存在する腫瘍を取り除くことが第一選択です。大きな腫瘍などで治癒切除に至らなかった場合や手術が困難な場合には、薬物療法を行います。
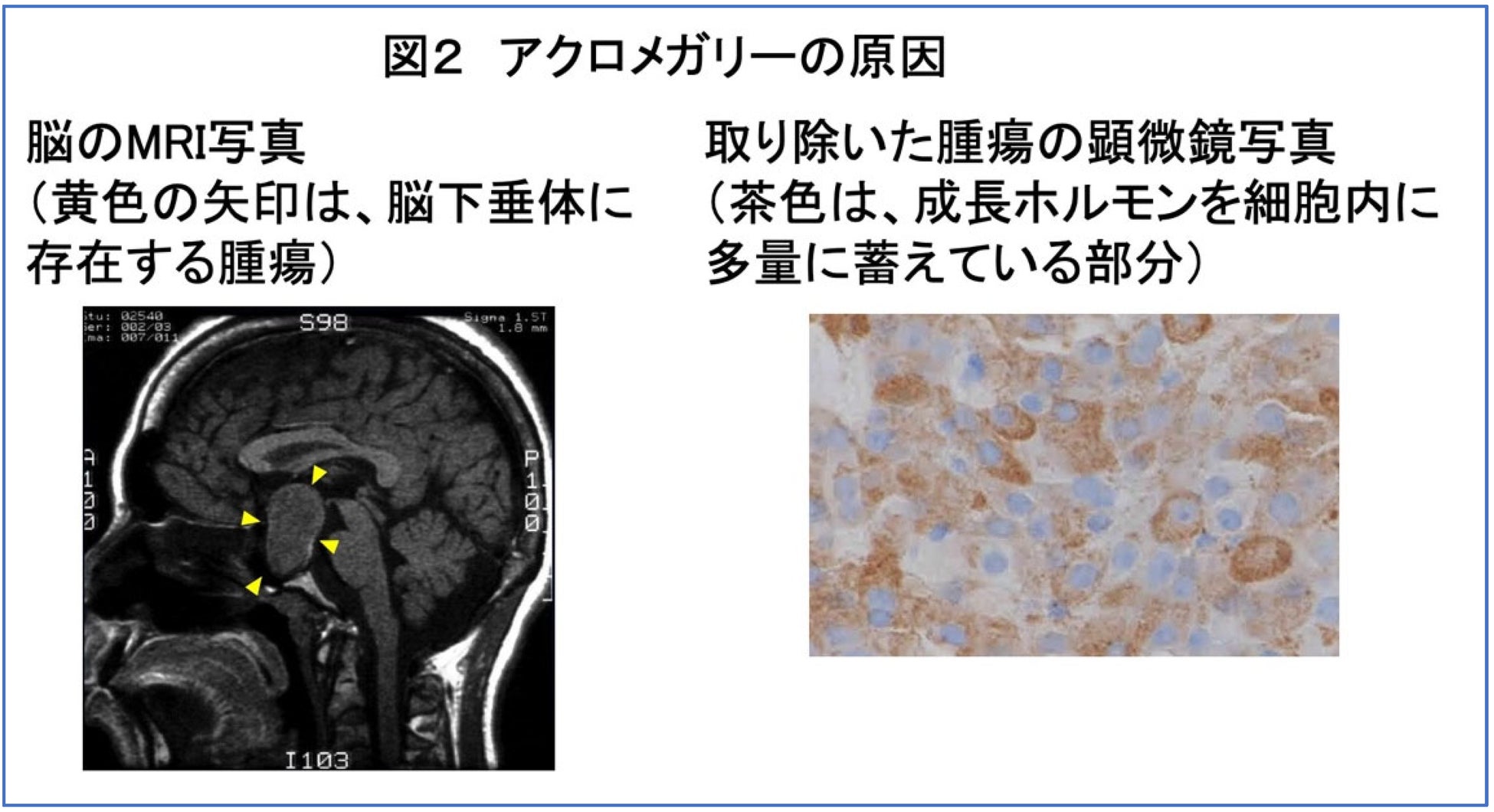
ソマトスタチンアナログ(注2)という薬剤は、成長ホルモンの分泌を抑制し、かつ腫瘍自体も縮小させる効果を持つ薬剤です。しかしながら、治療抵抗性の症例も少なくなく、より効果的な治療ターゲットを探索するために、アクロメガリーの分子生物学的特性を調べることが求められています。本研究では、ターゲットキャプチャーシーケンス(注3)とノンターゲットプロテオミクス(注4)という最新の技術を使って、以下の点を明らかにしました。
- 研究の内容
アクロメガリーでは、腫瘍にGNASと呼ばれる遺伝子変異を認めることが広く知られています。ターゲットキャプチャシーケンスから、57.0%の症例でGNASに活性化変異を有することを認めました。多くは、すでに知られているホットスポットにおける変異でしたが、新規のGNAS変異を3症例に認めました。また、アクロメガリーに関連の深い遺伝子(AIP、GPR101、SSTR5、ARRB1/2)や、cAMP経路に関与する遺伝子(PRKACA、PRKACB、PRKAR1A)の変異も検出されました(図3)。

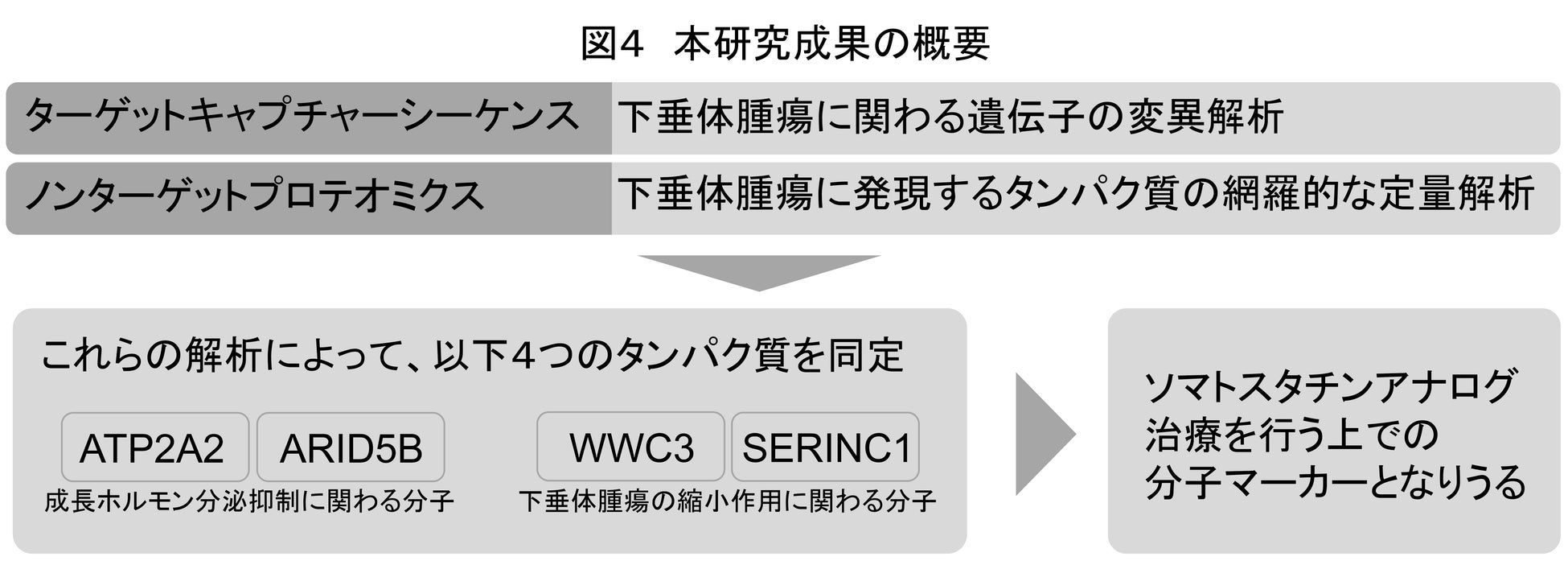
一般に、ソマトスタチンアナログの効果は、オクトレオチドという薬剤を使用した負荷試験で確認します。そこで、ノンターゲットプロテオミクスから得られた全タンパク発現量とオクトレオチド負荷試験における成長ホルモンの変化率の相関解析をしました。すると、ATPase sarcoplasmic/endoplasmic reticulum Ca2+ transporting 2 (ATP2A2)というタンパク質と、AT-rich interaction domain 5B (ARID5B)タンパク質の発現が高いほど、薬剤の感受性が高いということがわかりました。
また、実際にソマトスタチンアナログの治療を行った症例の腫瘍体積の変化率についても同様に相関解析をしました。すると、WWC family member3 (WWC3)タンパク質およびserine incorporator 1 (SERINC1)タンパク質は、ソマトスタチンアナログ治療を行う上で、その効果を予測する重要な分子マーカーになる可能性が示されました(図4)。
- 今後の展開
本研究結果から、アクロメガリーの治療薬ソマトスタチンアナログに対する反応性に関わるタンパク質をノンターゲットプロテオミクスから見つけることに成功しました。しかしながら、これらのタンパク質がアクロメガリーという病気にどの程度関わっているのかは、まだ明らかではありません。研究チームは今後、下垂体腫瘍での組織学的な発現とこれらの分子の機能を調べることで更なる分子メカニズムの解明を目指しています。それによって、アクロメガリーに有効な治療法の開発と薬物治療の選択肢が広がり、今よりも多くのアクロメガリーの治癒につながることが期待できます。
- 用語解説
(注1)アクロメガリー:先端巨大症とも呼ばれる。額、鼻やあごが大きくなる特徴的な顔貌と、手足など体の先端が肥大する病気。脳にある下垂体という部分に腫瘍ができることで発症する。国の指定難病に登録されている。
(注2)ソマトスタチンアナログ:細胞膜に発現するソマトスタチン受容体に作用する薬剤。それによって、成長ホルモンをはじめとして、さまざまな内分泌ホルモンの抑制効果を発揮する。
(注3)ターゲットキャプチャーシーケンス:特定のゲノム領域を選択的に増幅させて、その配列を決定する手法。従来のサンガー法よりも、短い時間で大規模かつ複雑なゲノム配列を決定することができる。
(注4)ノンターゲットプロテオミクス:細胞に含まれるタンパク質を一度に多数検出することができる手法。探索的な研究に利用されることが多い。
- 研究プロジェクトについて
本研究は、以下の支援を受けて遂行されました。
・日本学術振興会・科学研究費補助金挑戦的研究(萌芽)難治性乳がんを標的としたがん悪性化と休眠スイッチ機構におけるp53の役割(研究代表者:田中知明)2021年度~2023年度
・日本学術振興会・科学研究費補助金基盤研究(C)脂質合成代謝機能プロファイルの変化がもたらす腫瘍制御の解明(研究代表者:永野秀和)2022年度~2025年度
- 論文タイトル
Proteogenomic Landscape and Clinical Characterization of GH-Producing Pituitary adenomas/ somatotroph pituitary neuroendocrine tumors.
GH産生下垂体腫瘍のプロテオゲノミクス解析と臨床的特徴についての関連
DOI https://doi.org/10.1038/s42003-022-04272-1


