ノバルティス ファーマ株式会社(本社:東京都港区、代表取締役社長:レオ・リー、以下「ノバルティス ファーマ」)は、本日、BRAF阻害剤「タフィンラー®カプセル 50mg・75mg」(一般名:ダブラフェニブメシル酸塩、以下「タフィンラー」)とMEK阻害剤「メキニスト®錠 0.5mg・2mg」(一般名:トラメチニブ ジメチルスルホキシド付加物、以下「メキニスト」)の併用療法について、「標準的な治療が困難なBRAF遺伝子変異を有する進行・再発の固形腫瘍(結腸・直腸癌を除く)」*および「BRAF 遺伝子変異を有する再発又は難治性の有毛細胞白血病」に対する効能又は効果の追加承認を取得しました。また、「標準的な治療が困難なBRAF遺伝子変異を有する進行・再発の固形腫瘍(結腸・直腸癌を除く)」では小児(26kg以上)患者での用法及び用量の追加が併せて承認されました。なお、対応するコンパニオン診断薬「 MEBGEN™ BRAF 3 キット」は本年11月1日に保険適用となりました**。
「タフィンラー」と「メキニスト」の併用は、BRAF V600遺伝子変異を有する腫瘍の増殖に関与するMAPKシグナル伝達経路の2つの作用点で、細胞増殖シグナルを阻害することにより、「タフィンラー」単剤に比べ、腫瘍増殖を阻害又は遅延させると考えられています。「タフィンラー」は、MAPKシグナルのBRAF変異型(V600E、V600K及びV600D)のキナーゼ活性を阻害し、腫瘍増殖を抑制します。「メキニスト」は、MEK1及びMEK2の活性化並びにキナーゼ活性を阻害することで細胞増殖シグナルがBRAF変異型のキナーゼ活性を介さない迂回経路で無秩序に細胞増殖や腫瘍増殖が生じるのを抑制すると考えられています。すでに承認を取得しているBRAF遺伝子変異を有する悪性黒色腫および非小細胞肺癌と同様に、その他の腫瘍においても「タフィンラー/メキニスト」併用により、強力かつ持続的な腫瘍増殖抑制効果が認められており、併用療法により予後を改善することが期待されます。
BRAF遺伝子変異の中でもっともよくみられるBRAF V600E遺伝子変異を有する腫瘍では、確立された治療体系はなく、原発部位に応じた標準治療や既存治療の効果は限定的であることが多いため、高いアンメットメディカルニーズが存在しています。BRAF V600E 遺伝子変異はさまざまながん種で認められますが、非小細胞肺癌、悪性黒色腫、結腸・直腸を除き、BRAF遺伝子変異陽性の固形腫瘍を効能・効果とした治療薬は承認されていませんでした。そこで、BRAF遺伝子変異の中でもっともよくみられるBRAF V600E 遺伝子変異陽性と分子的に定義される集団での、がん種横断的な試験として、成人のBRAF V600E 遺伝子変異陽性の希少がん患者を対象とした「タフィンラー/メキニスト」併用療法の臨床試験(X2201試験、ROAR)が2014年に開始されました。このX2201試験は、国立がん研究センター中央病院が希少がん治療開発の産学共同の試みとして実施するMASTER KEY プロジェクトにおいて最初の副試験として選定されました 。
この度の効能又は効果及び用法及び用量の追加承認は、主に5つの臨床試験(成人:X2201試験、XUS35T 試験、およびNCCH1901 試験、小児:A2102 試験およびX2101 試験)のデータに基づいています。BRAF V600E 遺伝子変異陽性の15種類を超えるがん種を対象とした5つの臨床試験から、「タフィンラー/メキニスト」併用療法は代替治療選択肢がない患者に対して臨床的なベネフィットをもたらすことが示されました。X2201 試験では、標準的な治療選択肢のないBRAF V600E 遺伝子変異を有する固形腫瘍患者、BRAF V600E 遺伝子変異を有する再発又は難治性の有毛細胞白血病患者(18 歳以上)等を対象に、有効性の評価が可能であった患者206例(日本人7例を含む)において、主要評価項目であるがん種により分類した各組織型コホートにおける奏効率(ORR、95%信頼区間[CI])は、甲状腺未分化癌は56%(38.1-72.1)、胆道癌は53%(37.7-68.8)、WHO grade 1又は2の神経膠腫で69%(38.6-90.9)、WHO grade 3又は4の神経膠腫で33%(20.0-49.0)、有毛細胞白血病 で89%(77.8-95.9)などでした。
成人X2201 試験及び小児X2101 試験で発現した有害事象の内容は、既承認適応症を対象とした臨床試験成績と大きな違いはなく、申請適応症及び小児患者に特有の安全性上の懸念は認められませんでした。
また、この度の効能又は効果の追加承認は、ノバルティスが協力する患者申出療養(NCCH1901試験)活用の初めての実用化となります。国立がん研究センター中央病院を中心とした国内12施設のがんゲノム医療中核拠点病院で進められているNCCH1901 試験は複数コホートが含まれるバスケット型の特定臨床研究で、タフィンラー/メキニストのコホートでは、日本人57 例の貴重な使用経験が報告され、良好な結果が得られています。
「タフィンラー」と「メキニスト」の併用療法の追加承認について、ノバルティス ファーマの代表取締役社長であるレオ・リーは次のように述べています。「同併用療法は、患者申出療養の経過や文献レビューの結果からも裏付けられ、発がん性BRAF V600E遺伝子変異が組織非依存的に作用するドライバー変異であることを示唆しています。 BRAF遺伝子変異を有する患者さんの多くは、標準治療が確立していない希少がんの診断を受け、治療を受けている方が多く、そうした患者さん、そしてご家族の不安や負担は計り知れません。同併用療法は、BRAF遺伝子変異を有する組織球症を含めた固形腫瘍への臓器横断的な効能として初めて承認された唯一のBRAF/MEK阻害薬であり、小児患者さんへの使用については、承認された唯一のBRAF/MEK阻害薬です。今回の追加承認が患者さんだけでなく、ご家族や治療に臨まれる医療従事者の方々の負担軽減と希望につながることを期待しています。」
両剤ともに今回承認された効能を含めすべての効能は厚生労働省より希少疾病用医薬品(オーファンドラッグ)に指定されています。
「タフィンラー」「メキニスト」併用療法について
BRAF/MEK阻害研究における世界的な分子標的療法の先駆的治療薬として患者さんに届けられた「タフィンラー/メキニスト」併用療法は、様々な種類のがんの増殖に関与するBRAFおよびMEKキナーゼに関連するシグナルを阻害して腫瘍の増殖を抑制する可能性があります1-2。「タフィンラー/メキニスト」併用療法は、実施中および完了した20以上の試験で6,000例以上のBRAF遺伝子変異陽性患者さんを対象に検討され、世界中で20万例以上の患者さんに処方されています。
BRAF V600E遺伝子変異について
BRAF V600E遺伝子変異は広範ながん種で認められており、その多くは希少がんであり、検出頻度はがん種によって異なります。BRAF遺伝子変異は、様々な固形腫瘍のがん増殖の促進因子とされており、BRAF V600E遺伝子変異は最もよくみられる種類のBRAF遺伝子変異であり、BRAF遺伝子変異がんの最大90%を占めます2。
*「組織球症患者は本剤の投与対象となり得る。」と関連する注意に記載。
**「 MEBGEN™ BRAF 3 キット」は株式会社 医学生物学研究所より販売予定です。
ノバルティス ファーマ株式会社について
ノバルティス ファーマ株式会社は、スイス・バーゼル市に本拠を置く医薬品のグローバルリーディングカンパニー、ノバルティスの日本法人です。ノバルティスは、より充実したすこやかな毎日のために、医薬の未来を描いています。詳細はホームページをご覧ください。

以上
参考文献
1. Pratilas C, et al. Curr Top Microbiol Immunol. 2012;355:82-98.
2. Turski ML, et al. Mol Cancer Ther. 2016;15:533-547.
<参考資料>
タフィンラー®カプセル 50mgと同カプセル75mgの製品概要
製品名:
-
「タフィンラー®カプセル 50mg」(TAFINLAR® Capsules 50mg)
-
「タフィンラー®カプセル 75mg」(TAFINLAR® Capsules 75mg)
一般名:
ダブラフェニブメシル酸塩
効能又は効果(下線部が今回追加):
-
BRAF遺伝子変異を有する悪性黒色腫
-
BRAF遺伝子変異を有する切除不能な進行・再発の非小細胞肺癌
-
標準的な治療が困難なBRAF 遺伝子変異を有する進行・再発の固形腫瘍(結腸・直腸癌を除く)
-
BRAF遺伝子変異を有する再発又は難治性の有毛細胞白血病
用法および用量または使用方法(下線部が今回追加):
-
BRAF遺伝子変異を有する悪性黒色腫:通常、成人にはダブラフェニブとして1 回150mg を1 日2回、空腹時に経口投与する。ただし、術後補助療法の場合には、トラメチニブと併用し、投与期間は12 カ月間までとする。なお、患者の状態により適宜減量する。
-
BRAF遺伝子変異を有する切除不能な進行・再発の非小細胞肺癌:トラメチニブとの併用において、通常、成人にはダブラフェニブとして1 回150mg を1 日2回、空腹時に経口投与する。なお、患者の状態により適宜減量する。
-
標準的な治療が困難なBRAF遺伝子変異を有する進行・再発の固形腫瘍(結腸・直腸癌を除く):
-
トラメチニブとの併用において、通常、ダブラフェニブとして以下の用量を1 日2 回、空腹時に経口投与する。なお、患者の状態により適宜減量する。
-
成人には、1 回150mg
-
小児には、体重に合わせて次の用量
-

-
BRAF遺伝子変異を有する再発又は難治性の有毛細胞白血病:トラメチニブとの併用において、通常、成人にはダブラフェニブとして1 回150mg を1 日2回、空腹時に経口投与する。なお、患者の状態により適宜減量する。
承認取得日:
2023年11月24日
製造販売:
ノバルティス ファーマ株式会社
メキニスト®錠 0.5mgと同錠2mgの製品概要
製品名:
-
「メキニスト®錠 0.5mg」(MEKINIST® Tablets 0.5mg)
-
「メキニスト®錠 2mg」(MEKINIST® Tablets 2mg)
一般名:
トラメチニブ ジメチルスルホキシド付加物
効能又は効果(下線部が今回追加):
-
BRAF遺伝子変異を有する悪性黒色腫
-
BRAF遺伝子変異を有する切除不能な進行・再発の非小細胞肺癌
-
標準的な治療が困難なBRAF 遺伝子変異を有する進行・再発の固形腫瘍(結腸・直腸癌を除く)
-
BRAF遺伝子変異を有する再発又は難治性の有毛細胞白血病
用法および用量または使用方法(下線部が今回追加):
-
BRAF遺伝子変異を有する悪性黒色腫: ダブラフェニブとの併用において、通常、成人にはトラメチニブとして2mg を1 日1 回、空腹時に経口投与する。ただし、術後補助療法の場合には、投与期間は12 カ月間までとする。なお、患者の状態により適宜減量する。
-
RAF遺伝子変異を有する切除不能な進行・再発の非小細胞肺癌: ダブラフェニブとの併用において、通常、成人にはトラメチニブとして2mg を1 日1 回、空腹時に経口投与する。なお、患者の状態により適宜減量する。
-
標準的な治療が困難なBRAF 遺伝子変異を有する進行・再発の固形腫瘍(結腸・直腸癌を除く):
-
ダブラフェニブとの併用において、通常、トラメチニブとして以下の用量を1 日1 回、空腹時に経口投与する。なお、患者の状態により適宜減量する。
-
成人には、2mg
-
小児には、体重に合わせて次の用量
-
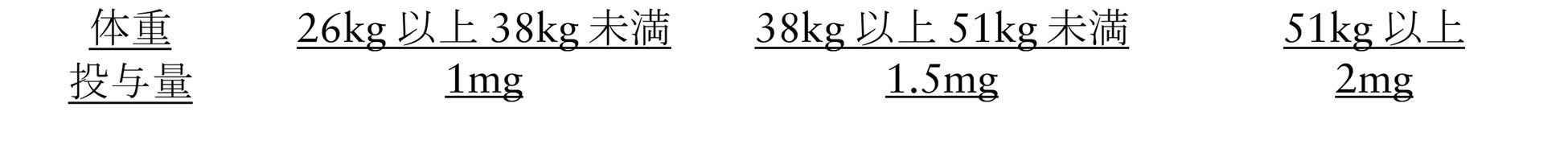
-
BRAF 遺伝子変異を有する再発又は難治性の有毛細胞白血病:ダブラフェニブとの併用において、通常、成人にはトラメチニブとして2mg を1 日1 回、空腹時に経口投与する。なお、患者の状態により適宜減量する。
承認取得日:
2023年11月24日
製造販売:
ノバルティス ファーマ株式会社
*効能又は効果に関連する注意並びに用法及び用量又は使用方法に関する注意は、添付文書をご覧下さい。


