本研究成果は,2022年8月21日に科学雑誌「Archives of Biochemistry and Biophysics」に公開されました。
- 1 研究のポイント
・ 高脂肪食摂取マウスでは、胃は大腸に比べ細胞変異が著しく早く、前がん状態に陥る。
・ 消化管上皮細胞特異的にLepRを欠損させると、前がん症状は胃で起こらず、大腸では部分的に抑制される。
・ LepR活性化の阻害は、胃で異所性に発現する分子を抑制し、胃の前がんを顕著に抑制することから、早期診断のバイオマーカー・新たながん治療薬の標的として期待できる。
- 2 研究の背景と概要
【背景】
肥満は様々な生活習慣病の原因だけでなく,様々な発がんの危険因子であります。しかしながら,食餌性脂質に対するそれぞれの組織の細胞の応答性や,がん形成への機序やその違いはわかっていませんでした。
レプチンは脂肪細胞から産生され視床下部に発現する受容体に結合し,食欲抑制やエネルギー代謝亢進を促すホルモンとして広く知られています。一方,レプチンは胃からも恒常的に産生され,管腔を伝って腸管に到達し,ペプチドや糖の吸収に重要な働きを示しますが,生理的意義の多くは不明です(図1)。また腸管は通常レプチンはほとんど産生しませんが,受容体は発現しています。稲垣教授はこれまでに,高脂肪食を正常マウスに摂取させると,胃レプチンの産生及びレプチンシグナルが摂取後早期から亢進することにより,腸上皮化生になることを報告しました(1〜3)。しかし,胃と大腸粘膜の高脂肪食に対する応答性及びその結果起こる病態発症機序はわかりませんでした。

【概要】
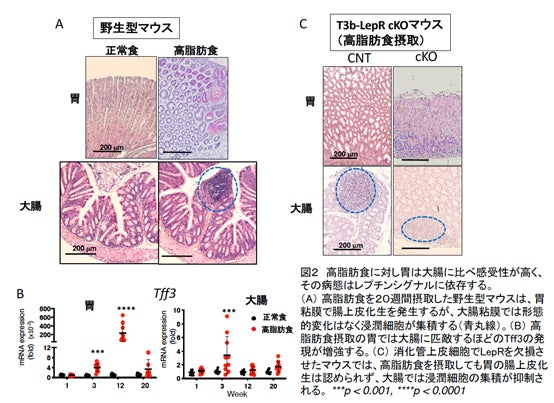
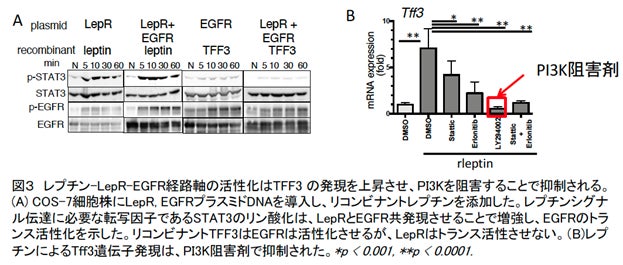
本研究で,食餌性肥満モデルマウスを用い,胃と大腸の病態の違いを比較しました。高脂肪食摂取により胃・大腸共にレプチンの産生が同レベルに認められました。しかし,胃では高脂肪食摂取後早期から,胃酸産生細胞の消失はじめ腸粘膜の形質を持つ腸上皮化生を示しました。一方,大腸では形態変化がほとんど見られず,かなり遅れて浸潤細胞の集積や上皮細胞の核で偽重層化*2が認められました(図2A)。消化管粘膜はムチンやそれに結合するペプチドで表面を覆われています。高脂肪食摂取により,正常な胃では発現しない腸型のムチンであるMuc2やペプチドであるトレフォイルファクター(TFF3)が,胃に異所性に顕著に増加しました(図2B)。別の研究グループから,TFF3は上皮成長因子受容体 (EGFR)の活性化を制御することが報告されています。高脂肪食摂取の胃では大腸よりEGFRの活性化が強いことが示されました。消化管上皮細胞特異的にLepRを欠損させた(T3b-LepR conditional knockout)マウスでは,胃の前がん症状はほぼ完全に抑制され,大腸でも浸潤細胞の集積が減弱しました(図2C)。また,レプチンシグナルでどの経路がTFF3発現に重要なのか,培養細胞を用い調べました。その結果,レプチンはLepRの活性化だけでなくEGFRをトランス活性化し(図3A),TFF3の発現にはPI3K-Akt経路が重要であることがわかりました(図3B)。
- 3 研究成果の意義と今後の展開
稲垣教授は先行研究で,レプチンシグナルの負の制御分子であるSOCS3を胃,小腸,大腸全ての消化管上皮細胞特異的に欠損させたマウスにおいて,胃でレプチン産生の増強及びそのシグナルの亢進により,胃のみで発がんが認められることを報告しました(4)。これは,胃と大腸のレプチンに対する細胞応答性が明らかに異なることを示しています。本邦で高脂肪高カロリーの欧米型の食生活の様式が定着し、肥満者の増加に伴い消化器がんの患者数も増加しています。現在,消化器がんの治療薬はありますが,副作用が強く,新たな診断法や治療薬が求められています。今後,組織特異的な消化器がんの発生・進展を考える上で,レプチン→EGFRトランス活性化→TFF3異所性誘導は,特に胃がんの早期診断におけるバイオマーカーや治療薬の標的の可能性を示しています。
- 4 発表雑誌
雑 誌 名:Archives of Biochemistry and Biophysics (Elsevier)
掲 載 日:2022年8月21日
D O I : 10.1016/j.abb.2022.109379
論文タイトル:Augmented leptin-induced trefoil factor 3 expression and epidermal growth factor receptor transactivation differentially influences neoplasia progression in the stomach and colorectum of dietary fat-induced obese mice. (レプチン誘導性トレフォイルファクター3発現と上皮成長因子受容体のトランス活性化は,高脂肪食マウスの胃と大腸において異なる作用で新生物化を促進させる)
著 者:Yuta Kinoshita, Seiya Arita, Takumi Ogawa, Ayane Takenouchi, Kyoko Inagaki-Ohara*
(* 責任著者)
【用語説明】
*1腸上皮化生 胃粘膜を腸粘膜の形質に変化させる現象。胃がん発生の高い危険病変と考えられている。
*2核偽重層化 核が基底に位置せず,細胞密度が高くなり基底や管腔側に位置するなど不均一な方向を示す。腫瘍化の一つの指標である。
【参考文献】
1. Leptin receptor signaling is required for high-fat diet-induced atrophic gastritis in mice. Inagaki-Ohara K., Okamoto S., Takagi K., Saito K., Arita S., Tang L., Hori T., Kataoka H., Matsumoto S., Minokoshi Y. Nutr. Metab. (2016) 13:7
2. High-fat diet feeding promotes stemness and precancerous changes in murine gastric mucosa mediated by leptin receptor signaling pathway. Arita S., Kinoshita Y., Ushida A., Enomoto A., Inagaki-Ohara K. Arch Biochem Biophys. (2016) 610:16-24.
3. High-fat-diet-induced modulations of leptin signaling and gastric microbiota drive precancerous lesions in the stomach. Arita S. and Inagaki-Ohara K. Nutrition (2019) 67-68: 110556.
4. Enhancement of leptin receptor signaling by SOCS3 deficiency induces development of gastric tumors in mice. Inagaki-Ohara K, Mayuzumi H, Kato S, Minokoshi Y, Otsubo T, Kawamura YI, Dohi T, Matsuzaki G, Yoshimura A. Oncogene (2014) 33(1):74-84.
【本発表資料のお問い合わせ先】
県立広島大学生物資源科学部生命環境学科 生体防御学研究室
教授 稲垣 匡子(イナガキ キョウコ)
TEL: 0824-74-1795 FAX: 0824-74-0191
E-mail: k-inagaki@pu-hiroshima.ac.jp
県立広島大学のウェブサイトはこちら
https://www.pu-hiroshima.ac.jp/



