【論文情報】
Crystal structure of Grimontia hollisae collagenase provides insights into its novel substrate specificity toward collagen.
Ikeuchi T, Yasumoto M, Takita T, Tanaka K, Kusubata M, Hayashida O, Hattori S, Mizutani K, Mikami B, Yasukawa K.
J. Biol. Chem. (2022) 298(8) 102109, doi: https://doi.org/10.1016/j.jbc.2022.102109
【関連製品】
ブライターゼ(Brightase)
https://www.nippi-inc.co.jp/product/chemistry/tabid/116/Default.aspx
【研究の背景】
コラーゲンはGly-X-Y(Gly:グリシン、XおよびY:任意のアミノ酸)の繰り返し配列からなるα鎖と呼ばれるポリペプチド鎖が三本会合してらせん構造をとった棒状の分子です。コラーゲンの三重らせん構造は一般的な消化酵素に対し耐性を示すことが知られていますが、細菌性コラゲナーゼはコラーゲンの三重らせん構造のY-Gly結合を加水分解します。最もよく研究されている細菌性コラゲナーゼは、ガス壊疽菌の一種であるC. histolyticum由来のコラゲナーゼ(ColG、ColH)です。C. histolyticumコラゲナーゼは、MEROPSタンパク質分解酵素データベースにおいてM9Bサブファミリーに属する酵素で、細胞単離のための組織分散用酵素として研究用途に用いられる他、1型糖尿病患者への膵島移植のための膵島分離や、デュピュイトラン拘縮(Dupuytren’s contracture)の治療、火傷や潰瘍、褥瘡における組織の除去といった医療用途に広く用いられています(※1)。当社では、ゼラチン存在下で活性の強いコラゲナーゼを産生する微生物 Grimontia (Vibrio) hollisae 1706B株を単離しました(※2)。さらに、G. hollisae 1706B株のコラゲナーゼ遺伝子を同定し、ブレビバチルス発現系を用いて安定かつ高活性なリコンビナントコラゲナーゼの作製に成功しました(※3)。他の細菌性コラゲナーゼとの相同性解析の結果、G. hollisaeコラゲナーゼは、MEROPSタンパク質分解酵素データベースにおいてM9Aサブファミリーに属することが明らかとなりました。本酵素は、C. histolyticumコラゲナーゼとは別のグループに分類され、さらにはVI型コラーゲンへの分解活性などC. histolyticumコラゲナーゼにはない特長を持ちます(※4)。本酵素の特性をさらに探るべく、触媒ドメインの結晶構造解析を行い、コラーゲン分解メカニズムの解明を試みました。
【研究成果】
G. hollisaeコラゲナーゼの触媒ドメイン(Ala88-Thr646)を精製し、蒸気拡散法にて結晶化を行いました。大型放射光施設SPring-8で収集したX線回折データとタンパク質構造予測プログラムAlphaFold2で得たモデル構造を用いて分子置換を行い、構造を決定しました。その結果、G. hollisaeコラゲナーゼの触媒ドメインは、C. histolyticumコラゲナーゼColGと同様に、活性化ドメイン(activator domain)とペプチダーゼドメイン(peptidase domain)から成る鞍型(saddle-shape)の構造をしている事が明らかとなりました。さらに、コラーゲンモデルペプチドGly-Pro-Hyp(Gly:グリシン、Pro:プロリン、Hyp:ヒドロキシプロリン)との共結晶の解析により、G. hollisaeコラゲナーゼの活性化ドメインには構造的に相同性の高い2ヶ所の領域があり(Act1、Act2)、この部位でコラーゲンモデルペプチドと結合する事がわかりました(図1)。G. hollisaeコラゲナーゼは、コラーゲンの分解過程において、活性化ドメインによりコラーゲン線維からコラーゲン分子を引き剥がし、さらにはコラーゲン分子の三重らせんを解いた上で、ペプチダーゼドメインによりポリペプチド鎖を切断すると予想されます。
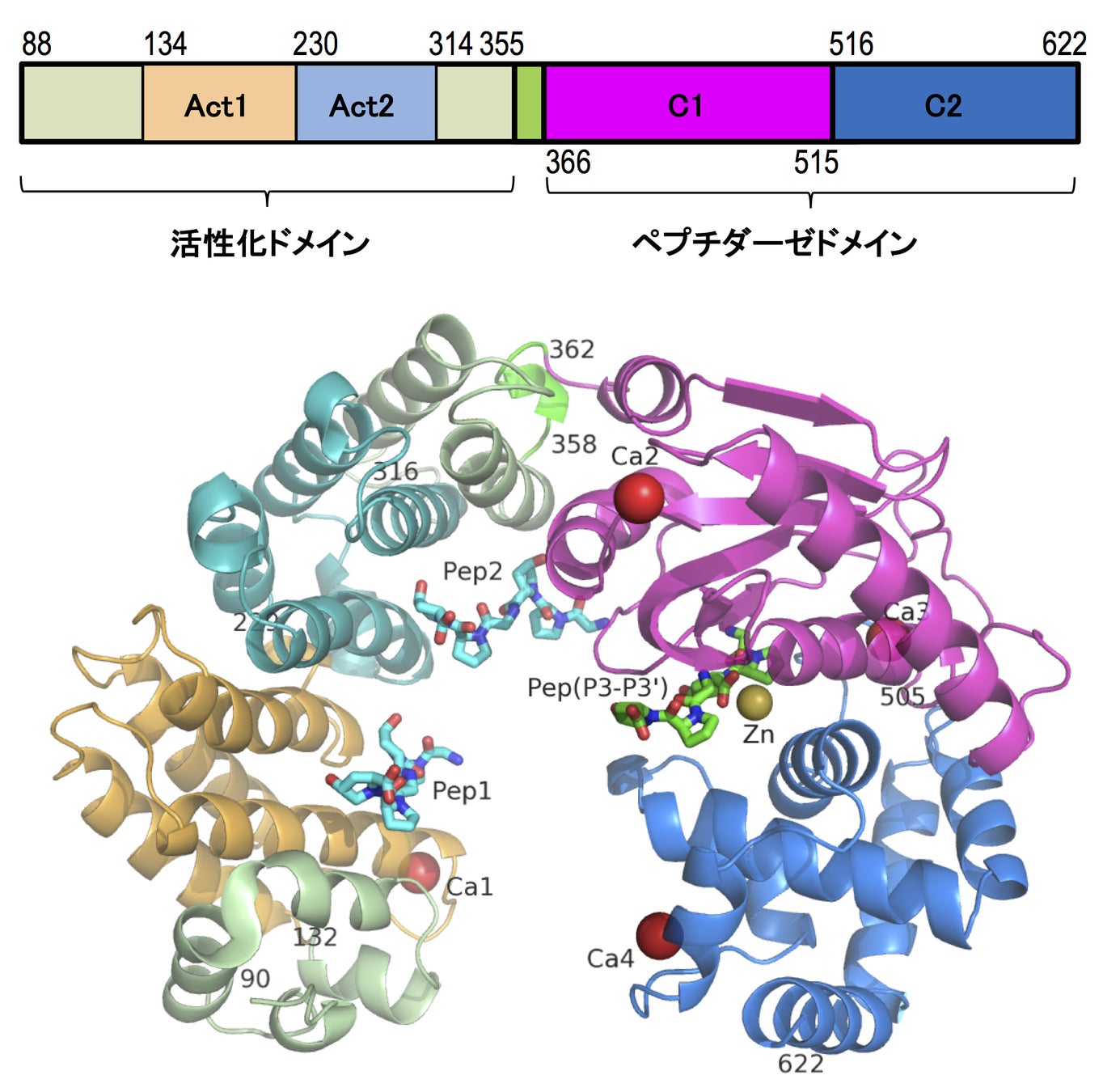
図1:コラゲナーゼの配列と結晶構造
結晶には1個の亜鉛と4個のカルシウムが配位している。コラーゲンモデルペプチドは緑(活性中心)と水色(活性化ドメイン)のスティックモデルで表示。
また、G. hollisaeコラゲナーゼとC. histolyticumコラゲナーゼ(Liberase™, Roche社)を用いてI型コラーゲンを消化し、トリペプチドの生成を比較したところ(図2A, 2B)、G. hollisaeコラゲナーゼでは20時間の反応でほぼトリペプチドにまで分解されるのに対し、C. histolyticumコラゲナーゼでは20時間で6割、48時間でも7割程度しか分解されませんでした。この差は、C. histolyticumコラゲナーゼがグルタミン酸を含むペプチドを切断できない一方で、G. hollisaeコラゲナーゼはグルタミン酸を含むペプチドでも切断でき(図2C, 2D)、効率的にコラーゲンをトリペプチドにまで分解できるからだと考えられます。
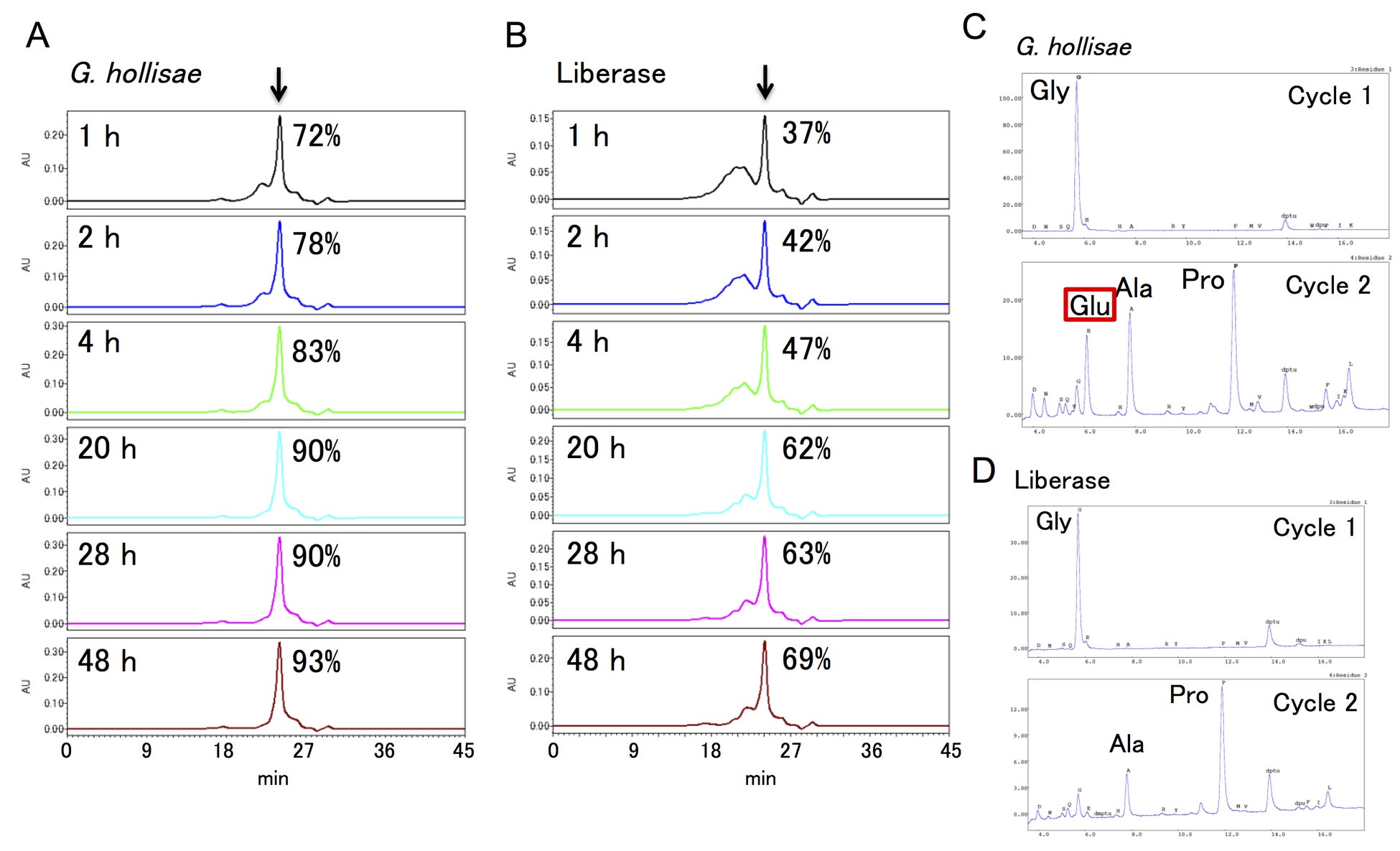
図2:ゲル濾過カラムクロマトグラフィーのクロマトグラム(A, B)と20時間反応させたトリペプチド画分のペプチドシークエンスの結果(C, D)
G. hollisaeコラゲナーゼがグルタミン酸を含むペプチドを切断できるのかを確かめるべく、活性中心にGly-Glu-Hypをフィッティングさせた実験では(図3)、C. histolyticumコラゲナーゼColGはグルタミン酸の側鎖が、515番目のフェニルアラニンおよび539番目のトリプトファンの側鎖と立体障害を起こす可能性が示唆されました。一方、G. hollisaeコラゲナーゼは活性中心のポケットの溝が深いため、立体障害は起きないと考えられます。すなわち、活性中心の構造の違いにより、コラーゲン配列における基質特異性に違いが現れたと推察されます。
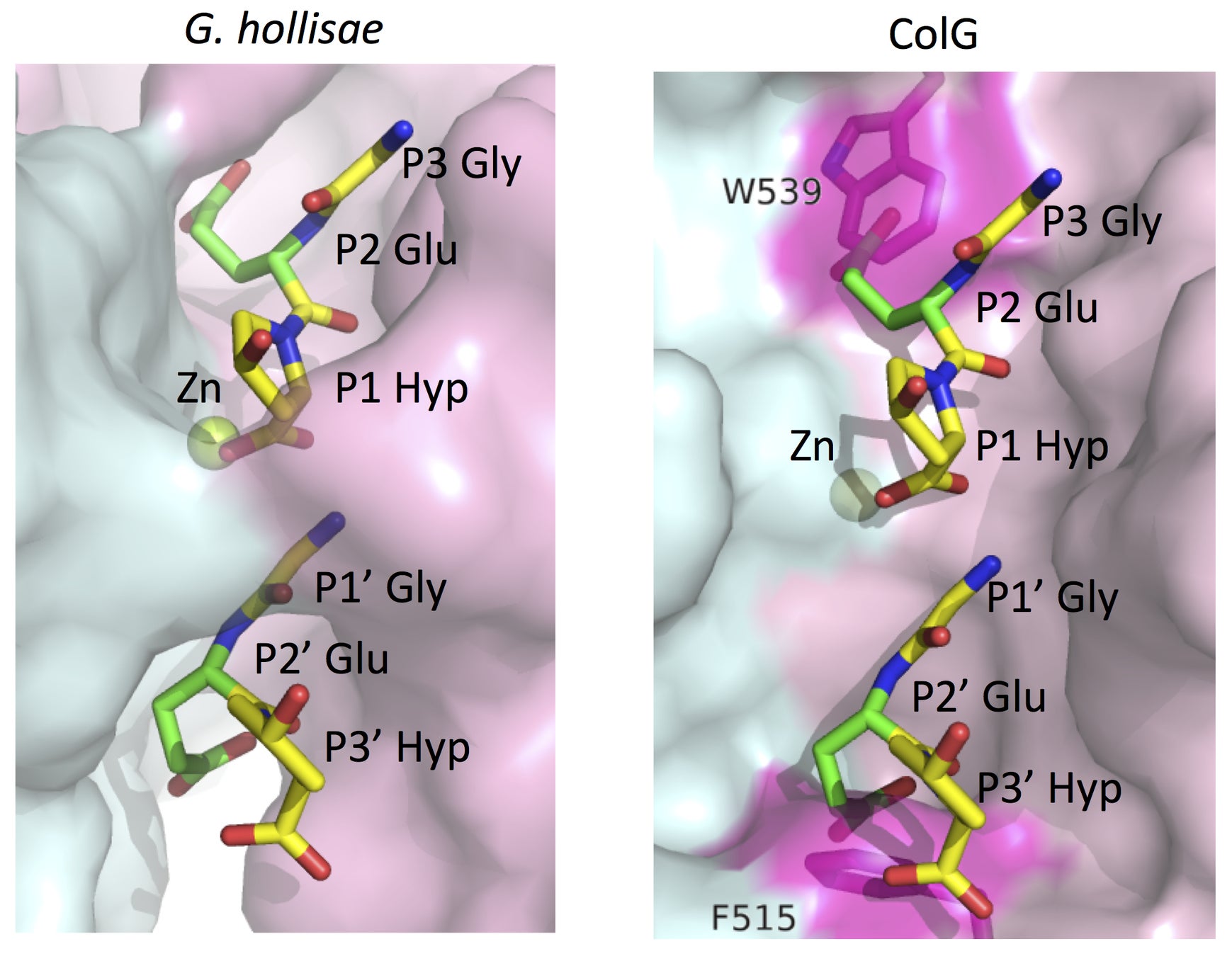
図3:G. hollisaeコラゲナーゼとC. histolyticumコラゲナーゼColGの活性中心の構造。G. hollisaeコラゲナーゼはポケットの溝が深いため、立体障害が起きない。
本研究から、鞍型の構造は細菌性コラゲナーゼの触媒ドメインの普遍的な構造であると考えられます。一方、活性中心の構造がG. hollisaeコラゲナーゼの特性に寄与していることも明らかとなりました。現状では、組織分散用酵素としてC. histolyticumコラゲナーゼが一般的に使用されていますが、特長の異なるG. hollisaeコラゲナーゼを用いることで単離細胞の収量や生存率などの改善が期待できます。また、G. hollisaeコラゲナーゼが持つコラーゲンをほぼ完全にトリペプチドに分解できる特長は、コラーゲン中のGly-X-Y配列またはX-Y配列の定量を可能にし(※5)、基礎研究(※6)や食品分析などにも応用可能です。
※1:Duarte AS et al. Crit Rev Microbiol. 42, 106-126 (2014)
※2:
Suzuki K and Matsubara Y. Hikakukagaku 44, 64-71 (1998)
Suzuki K. Hikakukagaku 45, 272-283 (2000)
※3:
Teramura N et al. J Bacteriol. 193, 3049-3056 (2011)
Tanaka K et al. Sci Rep. 10, 3927 (2020)
※4:当社ウェブサイト「Grimontia hollisae由来リコンビナントコラゲナーゼの開発」
https://www.nippi-inc.co.jp/biomatrix/tabid/172/Default.aspx?itemid=543
※5:特許6864539号 「コラーゲン、ゼラチンおよびコラーゲン加水分解物に含まれるGly-X-Y配列量の測定方法、およびX-Y配列量の測定方法」
※6:Taga Y et al. Anal Chem. 92, 8427-8434 (2020)
【お問い合わせ先】
本記事および製品に関するお問い合わせ … https://www.nippi-inc.co.jp/tabid/140/Default.aspx


