また、この開発に関する論文をSAGE Publishing(https://uk.sagepub.com/en-gb/asi/home)が発行するTechnology in Cancer Research & Treatmentに投稿し、2022年12月7日に論文が掲載されたことをお知らせします。(掲載箇所:https://journals.sagepub.com/doi/10.1177/15330338221142674)

■本研究成果の概要
胃の内視鏡的粘膜下層剥離術検体病理組織デジタル標本において、低分化腺癌を高精度に検出する人工知能の開発に成功しました。
■本研究の背景
内視鏡的粘膜下層剥離術(ESD:Endoscopic Submucosal Dissection)は、2006年より胃で最も早く保険収載され、現在では、保険治療としての標準的な早期胃癌に対する内視鏡治療として確立されています。胃は、粘膜、粘膜筋板、粘膜下層、固有筋層、漿膜という5層から構成されており、腺癌は最も内腔表面の粘膜から発生します。そのため、この治療法では、早期胃癌の中でもさらに早期な病変に対して、胃カメラで内腔から粘膜を含めた粘膜下層までを剥離し、病変を一括で切除します。
内視鏡的粘膜下層剥離術の適応要件として、腺癌の分化型・未分化型(低分化型)や浸潤程度(粘膜内か粘膜下層か)などが関係してきますが(文献:胃癌に対するESD/EMRガイドライン第二版)、生検時の診断で、内視鏡的粘膜下層剥離術の適応であったとしても、摘出検体による病理組織学的検討においては、低分化型腺癌の成分が確認されることがあります。したがって、内視鏡的粘膜下層剥離術の病理組織検体において、低分化型腺癌の有無を評価することは、術後の臨床的対応も含めて極めて重要です。
これまで、われわれは、胃の内視鏡生検病理組織デジタル標本における低分化腺癌の分類・検出を可能にする人工知能を開発してきたため(文献:Scientific Reports, 11: 20486, 2021)、本モデルが胃内視鏡的粘膜下層剥離術検体において適用可能かどうかを調べたところ、ROC-AUCが0.638~0.899となり、十分な精度が得られませんでした。原因として、内視鏡的粘膜下層剥離術検体では、粘膜層~粘膜下層までの組織構造が得られているのに対して、内視鏡生検検体では、表面の粘膜層に限局しており、組織構造が異なることを一因として考察しました。そこで、本研究では、胃内視鏡的粘膜下層剥離術の病理組織デジタル標本において、高精度に胃低分化腺癌を検出する人工知能モデルの開発を行うことしました。
■本研究の内容
本研究では、国内の複数の医療機関から、胃の内視鏡的粘膜下層剥離術検体、内視鏡生検、手術検体のHE染色病理組織標本の提供を受け、デジタルスライドスキャナーでデジタル標本(WSI: whole slide image)を作成しました。教師用データには、内視鏡的粘膜下層剥離術検体のみを用い、既存の内視鏡生検検体における低分化腺癌検出モデル(文献:Scientific Reports, 11: 20486, 2021)を転移学習させ、弱教師あり学習(weakly supervised learning)のみを行うことで、病理医による精密且つ大量のアノテーションデータを用いることなく、内視鏡的粘膜下層剥離術検体における低分化腺癌を検出する深層学習型人工知能を開発しました。開発した人工知能は、教師用データとは異なる内視鏡的粘膜下層剥離術検体および内視鏡生検検体、手術検体において精度検証を行い、本モデルの検体間における汎用性を検証しました。
■本研究の成果
開発した胃低分化腺癌検出を行う人工知能モデルを検証したところ、内視鏡的粘膜下層剥離術検体において、ROC-AUCが0.955~0.975という高い精度が得られました。一方、他の検体におけるROC-AUCは、内視鏡生検が0.937~0.960、手術検体が0.929でした。既存の内視鏡生検検体における低分化腺癌検出モデル(文献:Scientific Reports, 11: 20486, 2021)よりも劣ったのは、内視鏡生検検体のみでした(内視鏡生検検体モデルでのROC-AUC:0.959~0.976)。したがって、今回開発した胃低分化腺癌検出モデルを、内視鏡的粘膜下層剥離術検体および手術検体に用い、既存の低分化腺癌検出モデルを内視鏡生検検体に用いることで、胃のあらゆる病理組織検体における低分化腺癌を高精度に検出することが可能となりました。
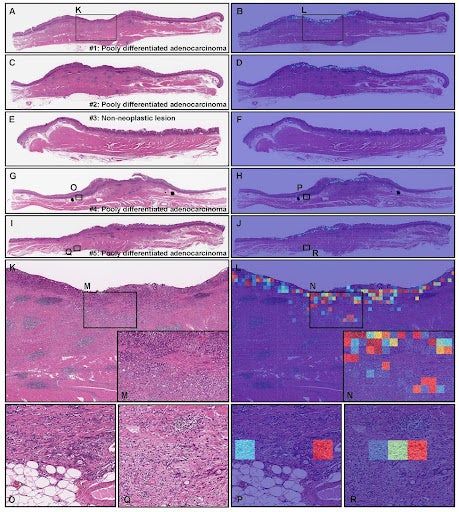
本研究における最大のインパクトは、既存の低分化腺癌検出モデルでは十分に分類・検出することができなかった内視鏡的粘膜下層剥離術検体において、低分化腺癌を高精度に検出する深層学習型人工知能の開発に成功したことです。本モデルの開発が完了したことで、胃の多くの病理組織検体において、人工知能により、ある程度汎用的に低分化腺癌を高精度に検出することが可能となりました。
今回開発した人工知能モデルの検証を、更に複数の施設ならびに大規模症例にて行い、検証試験を進めてまいります。
■原著論文
▼論文タイトル: Weakly Supervised Learning for Poorly Differentiated Adenocarcinoma Classification in Gastric Endoscopic Submucosal Dissection Whole Slide Images
▼日本語訳: 内視鏡的粘膜下層剥離術検体における胃低分化腺癌の検出を可能にする弱教師あり学習を用いた人工知能の開発
▼DOI: https://doi.org/10.1177/15330338221142674
■著者・所属
<メドメイン株式会社>
常木 雅之、Fahdi Kanavati
※この成果は、国立研究開発法人新エネルギー・産業技術総合開発機構(NEDO)の助成事業の結果得られたものです。
■会社概要
【会社名】メドメイン株式会社 (Medmain Inc.)
※経済産業省 J-START UP 選出企業 https://www.j-startup.go.jp/startups
【設立日】2018年1月11日
【事業内容】医療ソフトウェア・クラウドサービスの企画・開発・運営および販売
【代表取締役/CEO】飯塚 統
【所在地】[東京オフィス] 東京都港区南青山2-10-11 A青山ビル2F / [福岡オフィス] 福岡県福岡市中央区赤坂2-4−5 シャトレサクシーズ104
■各種関連サイト
【コーポレートサイト】https://medmain.com
【プロダクトサイト】https://service.medmain.com
■お問い合わせ先
メドメイン株式会社 広報担当: pr-m@medmain.com


