本研究成果のポイント
-
α-シヌクレイノパチー患者血清でRT-QuIC法と免疫沈降法(IP)とを組み合わせたIP/RT-QuIC法を開発
-
α-シヌクレイノパチーにおいて血液中を循環するα-シヌクレインシードを発見
-
血清に存在するα-シヌクレインシードは疾患ごとに構造や性質が異なることを発見
-
α-シヌクレイノパチーの診断およびより正確な鑑別診断、α-シヌクレイノパチー病態解明へ期待
背景
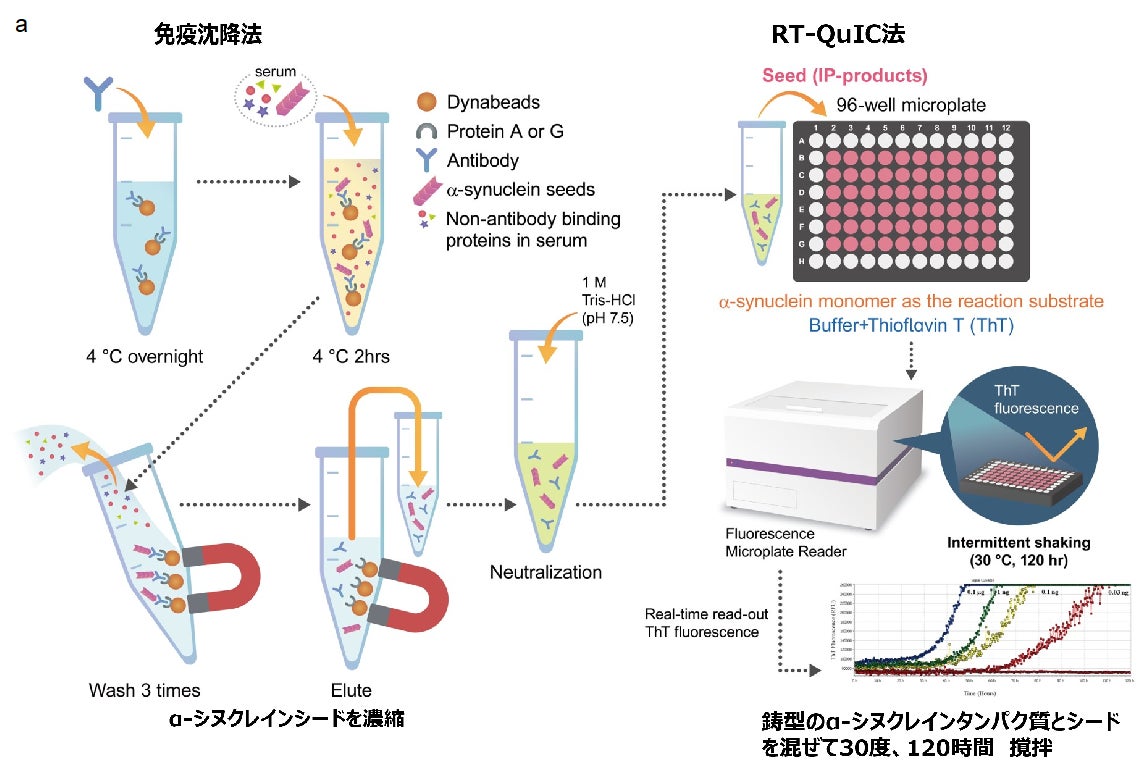
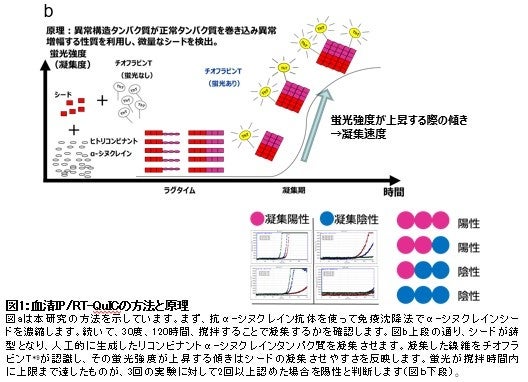
パーキンソン病(*1)やレビー小体型認知症(*2)、パーキンソン症候群(*3)である多系統萎縮症(*4)では、脳及び全身にα-シヌクレイン(*5)というタンパク質の凝集体が病的に出現し神経細胞死を引き起こすことが知られています。これらの疾患は、凝集しやすい異常構造型α-シヌクレインが脳に蓄積し神経細胞が脱落する疾患で、α-シヌクレイノパチー(*6)と総称されます。α-シヌクレイノパチーはふるえ、こわばり、動きが鈍くなるといったパーキンソン症状、認知症、自律神経機能障害、睡眠障害など多彩な症状を伴う進行性の難病ですが、現在の治療法は対症療法のみであり根治療法の開発が求められています。最近の研究で、この疾患は脳だけではなく全身の末梢神経にα-シヌクレインが蓄積することが明らかとなっており、研究グループは「全身への病気の広がりに血液を介した経路が関与している可能性がある」という仮説を立てました。そこで患者さんの血清から、α-シヌクレインシードを免疫沈降法 (IP)(*7)により濃縮し、凝集しやすい異常構造タンパク質をreal-time quaking-induced conversion(RT-QuIC)法で増幅することにより、極微量のα-シヌクレインシードを容易に検出するIP/RT-QuIC法を開発しました(図1)。この方法を用いて、α-シヌクレイノパチーの診断や鑑別、さらには病態解明のために、患者さんの大規模なスクリーニングを実施しました。
内容
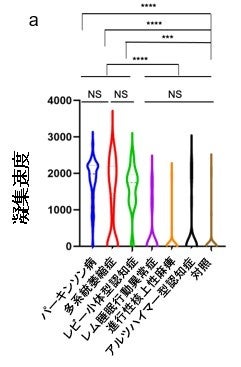
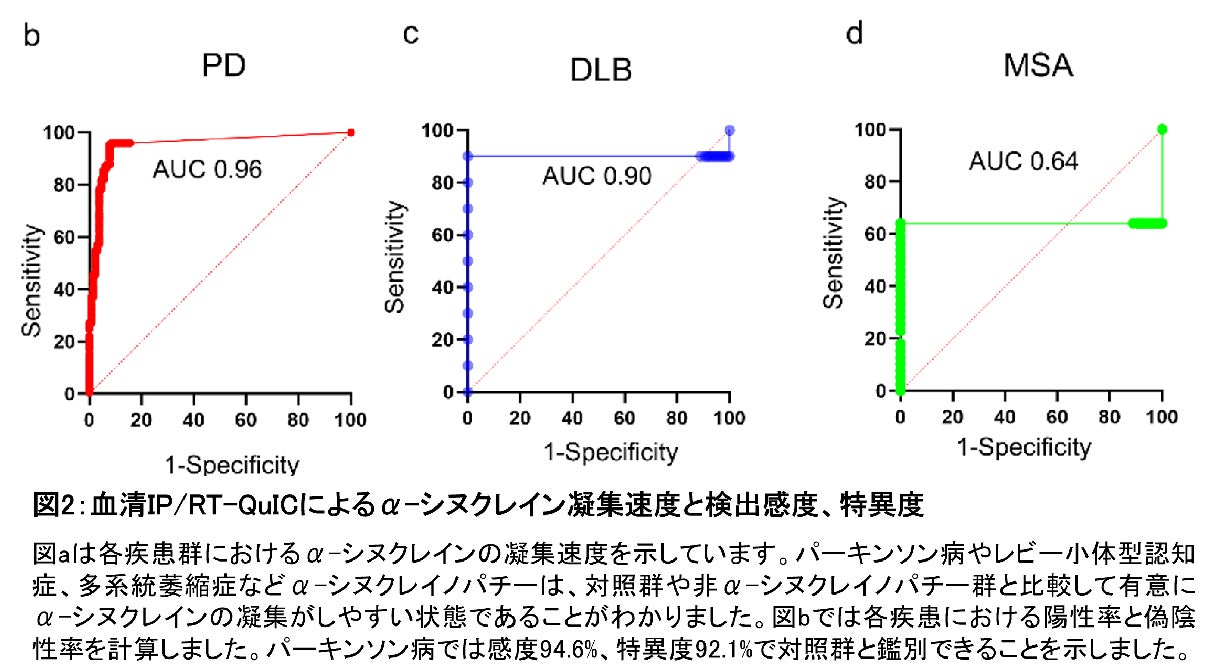
本研究では、α-シヌクレイノパチー患者270名、非α-シヌクレイノパチー患者55名、神経変性疾患ではない健常者128名、parkin遺伝子に変異のある家族性パーキンソン病(PARK2)患者17名、前駆期α-シヌクレイノパチーであるレム睡眠行動異常症(RBD)患者9名の血清サンプルから、免疫沈降法(IP)を用いてα-シヌクレインシードを濃縮し、RT-QuIC法を用いて病的α-シヌクレインを増幅しました。その結果、 α-シヌクレイノパチーであるパーキンソン病で95%、レビー小体型認知症で90%、多系統萎縮症で64%、またレム睡眠行動異常症では44%の患者さんからα-シヌクレインシードが検出されました。非α-シヌクレイノパチー全体では9%、対照では8.5%、PARK2患者では0%の検出率であり、α-シヌクレイノパチー群でのα-シヌクレインシードの検出が有意に高い結果になりました(図2)。また、病理で診断が確定した症例についてはレビー小体病で100%、多系統萎縮症で33%、対照では0%の確率で検出することができました。ルクセンブルク大学との共同研究ではパーキンソン病20名、対照20名、多系統萎縮症15名の血清サンプルでIP/RT-QuIC法を行ったところ、α-シヌクレインシードの検出率はパーキンソン病で75%、対照で5.0%、および多系統萎縮症で53%となりました。つまり、この方法を用いることで、血清によってα-シヌクレイノパチーであるという診断ができます。
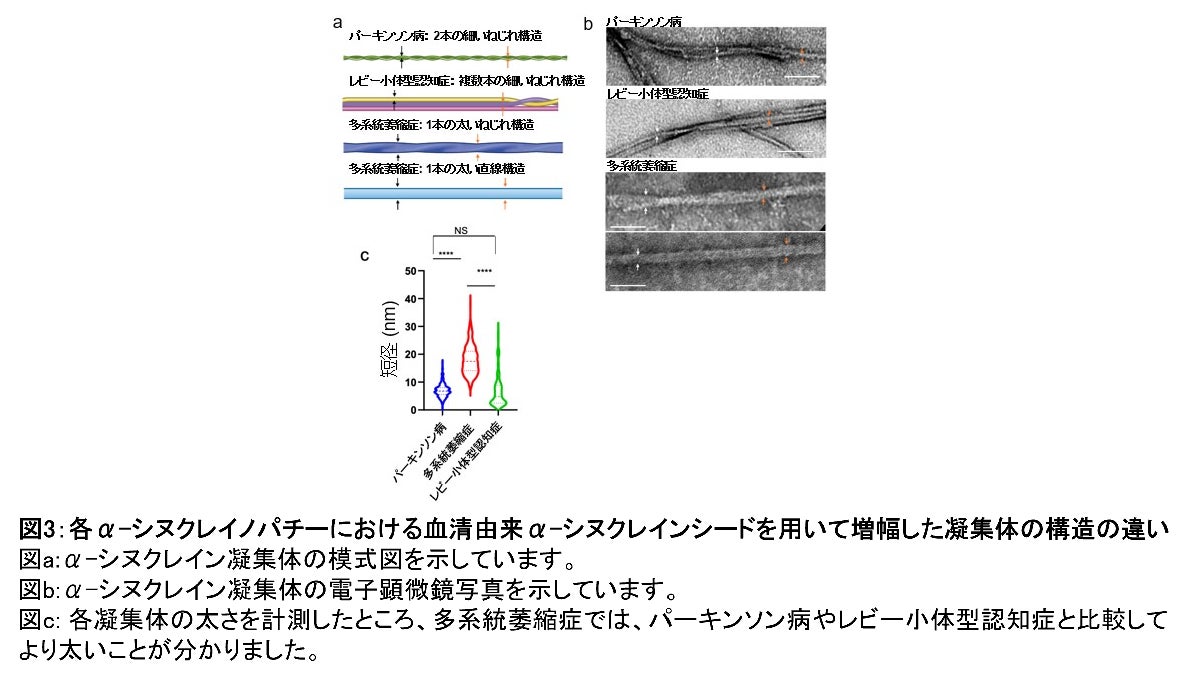
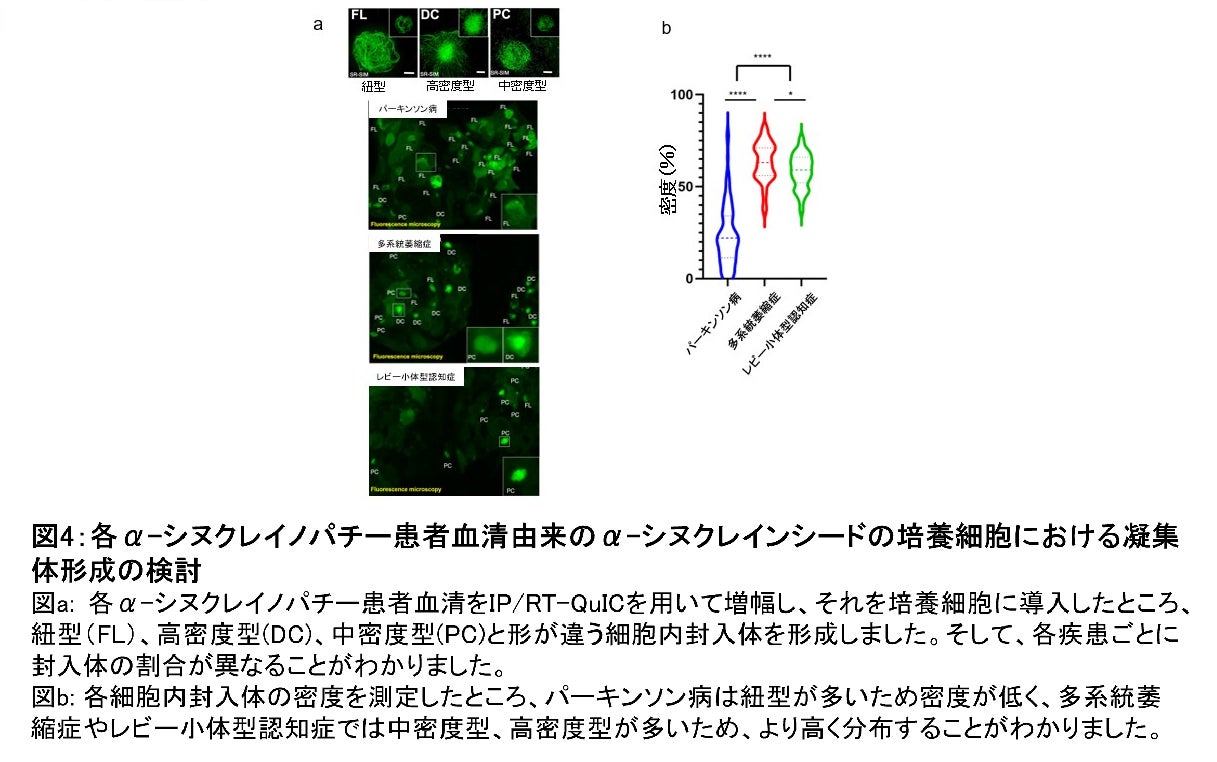
また、各疾患患者群の血清から増幅したα-シヌクレイン凝集体を電子顕微鏡で確認したところ、パーキンソン病では2本の細い線維がねじれた構造を、レビー小体型認知症では数本の線維が複雑にねじれた構造を、また多系統萎縮症では太い線維がねじれる、または直線的な構造を示しており、疾患ごとに構造が異なることがわかりました(図3)。次に、α-シヌクレイノパチー患者血清から増幅したα-シヌクレイン凝集体が、鋳型としてどのような性質を有するかを培養細胞を用いて検討しました。増幅したα-シヌクレイン凝集体を、GFP結合A53T変異型α-シヌクレインを安定発現させたHEK293T細胞へ導入し、細胞内に形成された凝集体を観察したところ、密度が低い紐型、高密度型、線維が絡み合いやや密度が低い中密度型と三つの異なった構造を持つ凝集体が観察され、各疾患で形成される凝集体の割合が異なることを見出しました(図4)。これらのことから、 形成された凝集体の形状を観察することでα-シヌクレイノパチーの中での疾患の鑑別も可能だとわかりました。
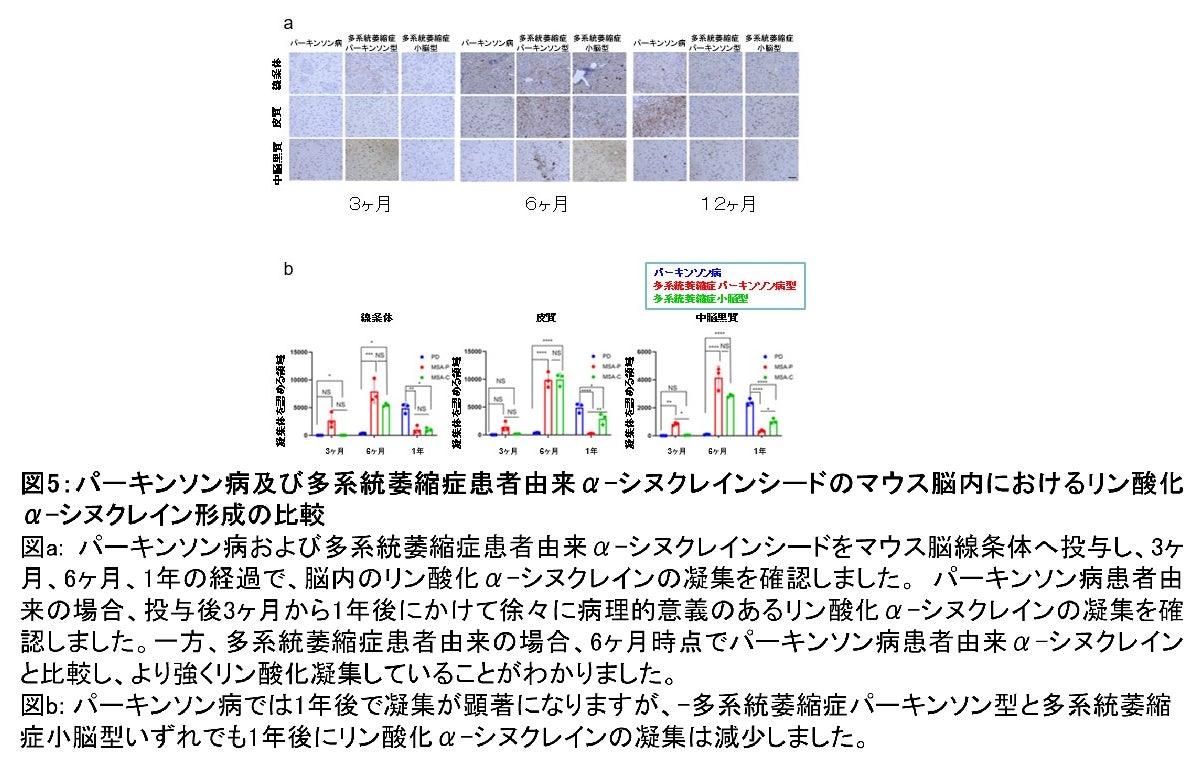
また、患者血清由来のα-シヌクレインシードを野生型マウスの線条体に投与し、α-シヌクレインシードの伝播と凝集について観察しました。パーキンソン病患者由来のα-シヌクレインシードを投与した場合、投与後3ヶ月から1年後にかけて徐々に病理的に異常なリン酸化α-シヌクレインの凝集体を確認しました。一方で、多系統萎縮症患者由来のα-シヌクレインシードを投与した場合では、6ヶ月時点でパーキンソン病患者由来のものと比較して、より多くリン酸化凝集体が蓄積していることがわかりました。さらに多系統萎縮症患者由来のものでは、投与の1年後にはリン酸化α-シヌクレインの凝集体は減少し、オリゴデンドロサイト(*8)の顕著な脱落が観察され患者脳で見られる病理と類似していました(図5)。以上のことから、患者血清由来のα-シヌクレインシードは、各α-シヌクレイノパチーの病態を形成する性質を有していることが示唆されました。
今後の展開
今回、研究グループはα-シヌクレイノパチー患者の血液中に存在するα-シヌクレインシードがα-シヌクレイノパチーの診断と鑑別のマーカーとして有用であることを世界で初めて明らかにしました。この発見から、病気の進行に血液中のα-シヌクレインシードも関与していることが考えられました。今後は疾患ごとに異なるα-シヌクレインシードの構造の違いを利用し、血液を用いた簡便かつ有用な診断方法を確立することを目指します。さらに、疾患ごとに凝集体の構造が異なる理由を解明することで、病態解明や疾患修飾療法開発への端緒になることも期待できます。
用語解説
*1 パーキンソン病: 日本で、アルツハイマー型認知症に次いで2番目に多い神経変性疾患で、運動機能障害を特徴とし、その有病率は10万人あたり100から180人とされています。様々な要因で発症すると考えられていますが、加齢の影響も受けることから、超高齢社会である本邦では、より増加すると考えられています。
*2 レビー小体型認知症: パーキンソン病とよく似ていますが、認知症が運動機能障害より目立つ疾患です。
*3 パーキンソン症候群: パーキンソン病に似ている症状を認める病気の一群のことです。神経変性疾患だけではなく脳血管障害などでも同様の症状を認めるため、パーキンソン病との鑑別が難しいことがあります。
*4 多系統萎縮症: 発症初期の症状はパーキンソン病の症状と類似していますが、レボドパ不応性のパーキンソン症候群の一種です。パーキンソン病と比較して、発症年齢は50歳代とやや若く、排尿障害や起立性低血圧など自律神経障害が目立ちます。
*5 α-シヌクレイン: 主に神経細胞に存在するタンパク質で、神経の機能を調整する役割を果たしていると考えられています。何らかの要因で、正常型α-シヌクレインから異常構造型α-シヌクレインに変化し、これは正常型を巻き込んで病的な凝集物を形成することで、神経変性に至らしめると考えられています。
*6 α-シヌクレイノパチー: 神経細胞やグリア細胞に異常構造型α-シヌクレインが凝集し神経変性をきたす疾患群を指します。α-シヌクレイノパチーには、パーキンソン病やレビー小体型認知症、多系統萎縮症などが含まれます。
*7 免疫沈降法(IP) : 特定のタンパク質などを抗原として認識する抗体を使って、標的となる抗原や抗原に親和性を示すタンパク質などを選択的に分離する方法です。
*8 オリゴデンドロサイト: 神経膠細胞(グリア細胞)の一種。神経の軸索を取り巻くように接着しミエリン鞘を形成する細胞のことです。
*9 チオフラビンT: 線維化したタンパクに結合すると強い蛍光を発する化学物質。
原著論文
本研究はNature Medicine誌のオンライン版で(2023年5月29日付)公開されました。
タイトル: Propagative α-synuclein seeds in serum of patients with synucleinopathies
タイトル(日本語訳): α-シヌクレイノパチー患者血清由来α-シヌクレインシードの伝播凝集メカニズム
著者:Ayami Okuzumi1), Taku Hatano1), Gen Matsumoto2), Shuko Nojiri3), Shin-ichi Ueno1), Yoko Imamichi1), Haruka Kimura1), Soichiro Kakuta4), Akihide Kondo5), Takeshi Fukuhara6), Yuanzhe Li1), Manabu Funayama1), Shinji Saiki1), Daisuke Taniguchi 1), Taiji Tsunemi1), Deborah McIntyre7), Jean-Jacques Gérardy8), Michel Mittelbronn8) Rejko Krüger7) Yasuo Uchiyama9), Nobuyuki Nukina10), and Nobutaka Hattori1), 6)
著者(日本語表記): 奥住文美1)、波田野琢1)、松本弦2)、野尻宗子3)、上野真一1)、今道洋子1)、木村遥1)、角田宗一郎4)、近藤聡英5)、常深泰司1)、福原武志6)、李元哲1)、舩山学1)、斉木臣二1)、谷口大祐1)常深泰司1) Deborah McIntyre7), Jean-Jacques Gérardy7), Michel Mittelbronn7) Rejko Krüger7)、内山安男8)、貫名信行9)、服部信孝1),6)
著者所属: 1)順天堂大学医学部神経学講座、2)長崎大学大学院医歯薬学総合研究科組織細胞生物学分野、3)順天堂大学革新的医療技術開発研究センター、4)順天堂大学大学院医学研究科研究基盤センター形態解析イメージング研究室、5)順天堂大学医学部脳神経外科学講座、6)理化学研究所脳神経科学研究センター神経変性疾患連携研究チーム、7)ルクセンブルク大学神経科学 8)順天堂大学大学院医学研究科老人性疾患病態・治療研究センター、9)同志社大学大学院脳科学研究科
DOI: 10.1038/s41591-023-02358-9
本成果は、AMED 脳とこころの研究推進プログラム(革新的技術による脳機能ネットワークの全容解明プロジェクト、精神・神経疾患メカニズム解明プロジェクト)等の支援から創出されました。同プログラムは、精神・神経疾患の分子的機序、診断及び治療に寄与するシーズ探索などの研究開発を推進し、また、霊長類の高次脳機能を担う神経回路を解明してヒトの脳の動作原理の理解に貢献するとともに、精神・神経疾患の早期発見・早期介入の実現や克服及び情報処理技術の高度化等を目指しています。当該疾患の克服に向け、AMEDは今後も必要な支援基盤の構築に努めて参ります。
本成果に活用されたAMED事業における研究課題
・AMED脳とこころの研究推進プログラム(革新的技術による脳機能ネットワークの全容解明プロジェクト)
「パーキンソン病発症前から発症後に連続する神経回路病態の解明とトランスレータブル指標の開発(研究代表 髙橋 良輔)」
・AMED脳とこころの研究推進プログラム(精神・神経疾患メカニズム解明プロジェクト)
「シヌクレイノパチーを全身病として捉えた病態解明と疾患修飾療法の開発(研究代表 波田野 琢)」
・AMED脳科学研究戦略推進プログラム
「α-シヌクレインの凝集および伝播に着目したレヴィ小体病の診断及び治療法の開発(研究代表 波田野 琢)」
・AMED創薬基盤推進研究事業
「パーキンソン病における疾患修飾薬候補の同定とprecision medicineの実現に向けたアカデミアと企業の技術融合による新たな創薬エコシステムの開発(研究代表 赤松和土)」
本研究は上記に加え、JSPS科研費 、 他の研究プロジェクトの一環として多施設との共同研究の基に実施されました。


